Die Evidenz für den schädigenden Einfluss von mütterlichem Rauchen in der Schwangerschaft ist in vielen Bereichen sehr gut dokumentiert (Tab.). Es kann mit großer Sicherheit davon ausgegangen werden, dass Rauchen in der Schwangerschaft einen starken und konsistenten negativen Einfluss auf das Geburtsgewicht, Plazenta-assoziierte Erkrankungen, Totgeburten, Frühgeburten, fetales Wachstum, SIDS, Übergewicht im späteren Kindesalter, Spaltbildungen, schlechtere Lungenfunktion, Asthma bronchiale, kardiovaskuläre Erkrankungen sowie mentale Entwicklungsverzögerung und ADHS hat. Diese Faktoren sind aus heutiger Sicht unter dem Begriff „Fetales Tabaksyndrom“ zu subsummieren. Einflüsse auf andere Gesundheitsaspekte sind (noch) weniger gut belegt und in vielen Bereichen sind noch weitere Studien nötig.
Epidemiologie
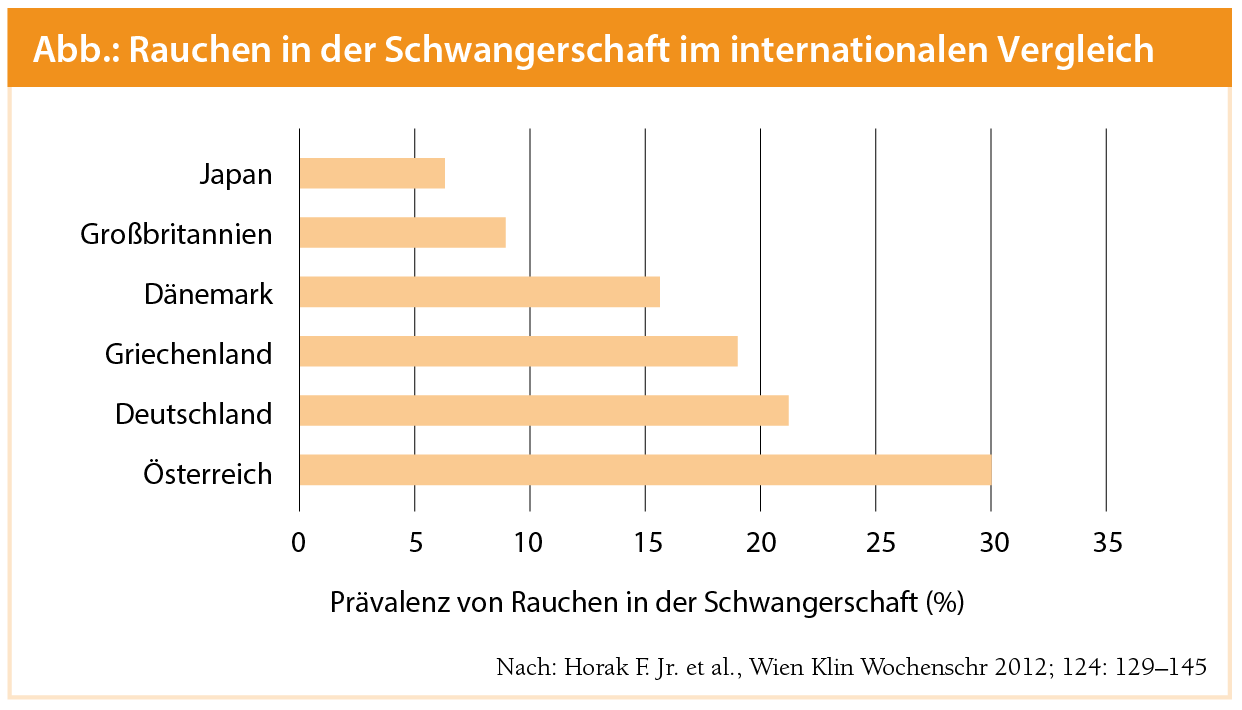
Eine Metaanalyse von 25 Studien zwischen 1966 und 2004 zeigte große Diskrepanzen in der Prävalenz von Rauchen in der Schwangerschaft1, 2, die zwischen 15 und 25 % zu liegen scheint3. In Deutschland liegt die Prävalenz von Rauchen während der Schwangerschaft bei 21 % [9], ähnlich der Prävalenz in Österreich mit 20 %–30 %4 (Abb.).
Beschriebene Gesundheitsschäden
- Fertilität: Es scheint insgesamt ein schwacher bis moderater Zusammenhang zwischen fetaler Rauchexposition und Infertilität bei Frauen und Männern zu bestehen. Bei Kindern von Müttern, die während der Schwangerschaft geraucht haben, kann die Passivrauchexposition unter anderem zu Infertilität im späteren Leben der Kinder führen, wie eine Metaanalyse von Studien zwischen 1966 und 2008 gezeigt hat.5
- Vorzeitige Plazentalösung und Placenta praevia: Insgesamt liegt eine umfassende Datenlage aus allerdings großteils retrospektiven Studien vor, die einen Zusammenhang zwischen vorzeitiger Plazentalösung bzw. Placenta praevia und Rauchen in der Schwangerschaft sehen.6, 7, 8
- Ektope Schwangerschaft: Es existieren zwar keine prospektiven Studien oder Metaanalysen, aber es zeigt sich doch in den vorhandenen Studien ein konsistenter Zusammenhang.5, 9 Eine dieser Studien10 zeigte auch eine deutliche Dosis-Wirkungs-Beziehung zwischen Anzahl der gerauchten Zigaretten und erhöhtem Risiko einer ektopen Schwangerschaft
- Spontanaborte: Insgesamt ist die Datenlage wenig konsistent. Ein Einfluss von Rauchen in (und auch vor) der Schwangerschaft auf die Entstehung eines Spontanaborts kann aber weder gesichert noch ausgeschlossen werden.
- Totgeburt: Die Evidenz für ein erhöhtes Risiko für eine Totgeburt ist sehr stark. In manchen Studien zeigte sich ein Schwellenwert von 10 Zigaretten pro Tag.11
- Frühgeburtlichkeit: Es besteht eine gute Evidenzlage zum relativ geringen, aber relevanten Einfluss von Rauchen in der Schwangerschaft auf die Frühgeburtlichkeit.12
- Fetales Wachstum und Geburtsgewicht: Zusammenfassend gibt es eine starke Evidenz für ein eingeschränktes Wachstum des Feten und verringertes Geburtsgewicht durch Rauchen in der Schwangerschaft.9, 14, 15, 16
- Malformationen: Das Risiko für einige beschriebene Malformationen wie Lippen-, Kiefer- oder Gaumenspalten scheint durch Rauchen in der Schwangerschaft erhöht.5, 17–20
- SIDS (Sudden Infant Death Syndrome): Insgesamt dürfte Rauchen in und nach der Schwangerschaft unabhängige, starke und konsistente Effekte auf das Risiko für SIDS haben.5, 9 Eine sehr aktuelle Analyse einer großen Geburtskohorte in den USA zeigte an über 3 Millionen Säuglingen, dass Rauchen in der Schwangerschaft für 23,2–33,6 % der SIDS-Fälle verantwortlich ist.13
- Allergien: Bisher konnte kein gesicherter Effekt von Rauchen in der Schwangerschaft auf die Entstehung von allergischer Sensibilisierung gezeigt werden.22 Die deutsche Geburtskohortenstudie „Multicenter Allergy Study“ (MAS) untersuchte den Einfluss von prä- und postnatalem Rauchen auf die Entstehung von allergischer Sensibilisierung im Säuglings- und Kleinkindesalter.23 Prä- und postnatal Rauch-exponierte Kinder zeigten hierbei ein signifikant erhöhtes Risiko für eine Sensibilisierung auf Nahrungsmittelallergene im Alter von 3 Jahren im Vergleich zu nicht exponierten Kindern (OR 2,3; 95 % CI 1,1–4,6). Für rein postnatal exponierte Kinder war dieses Ergebnis nicht signifikant, sodass ein pränataler Anteil des Effekte angenommen werden kann.
- Lungenfunktion: Es konnte in mehreren Studien belegt werden, dass Rauchen während der Schwangerschaft mit einer verringerten Lungenfunktion beim Neugeborenen und Kind assoziiert ist.25
- Asthma: Maternales Rauchen während der Schwangerschaft bringt ein substanziell und signifikant erhöhtes Risiko für das spätere Auftreten von Asthma vom Kindes- bis zum Erwachsenenalter mit sich.24, 26
- Infektneigung: Wenngleich die Wirkungen der prä- und postnatalen Expositionen schwer voneinander getrennt werden können, scheint die Tabakrauchexposition in utero mit Infekten der Atemwege in der frühen Kindheit im Zusammenhang zu stehen.27
- Autoimmunerkrankungen: Trotz Hinweisen aus Tierversuchen scheint derzeit kein gesicherter Zusammenhang zwischen fetaler Tabakrauchexposition und Autoimmunerkrankungen zu bestehen.28
- Adipositas und Diabetes mellitus Typ 2: Insgesamt gibt es eine sehr gute Evidenz für ein erhöhtes Risiko von Übergewicht in der Kindheit und Diabetes mellitus Typ 2 im späteren Leben durch fetale Tabakrauchexposition.29
- Kardiovaskuläre Erkrankungen: Das Risiko für kardiovaskuläre Pathologien im Kindesalter ist nach fetaler Tabakrauchexposition erhöht.30–35
- Hämatologische Erkrankungen: Fetale Tabakrauch-exposition scheint bis auf eine Erhöhung des fetalen Hämoglobins keine unmittelbare Auswirkung auf das hämatopoetische System zu haben, wenngleich Spätschäden durch die im Tabakrauch enthaltenen toxischen Substanzen nicht auszuschließen sind.
- Maligne Erkrankungen (ausgenommen hämatologische Erkrankungen): Die im Erwachsenenalter bekannte Assoziation von Passivrauch-Exposition und malignen Erkrankungen lässt sich bezüglich einer fetalen Belastung für das Kindesalter nicht sicher nachweisen, allerdings ist hier die Datenlage widersprüchlich.36 Im Gegensatz dazu zeigte eine prospektive Geburtskohortenstudie mit 1,4 Millionen Kindern ein erhöhtes Risiko von Kindern mit Müttern, die in der Schwangerschaft geraucht hatten, an benignen und malignen Hirntumoren zu erkranken (OR 1,24; 95 % CI 1,01–1,53).37
- Augen: Es existiert relevante Literatur mit gewisser Evidenz für eine Assoziation von Schielen und mütterlichem Rauchen in der Schwangerschaft, wobei hier vermutlich das 3. Trimenon eine besonders vulnerable Phase darstellt.38
- Otitis media: Die Studienlage zum Einfluss von Rauchen in der Schwangerschaft auf die Entwicklung einer Otitis media in früher Kindheit ist noch nicht ausreichend für eine letztgültige Beurteilung.
- Gastrointestinale Erkrankungen: Die Datenlage zu einem möglichen Zusammenhang von gastrointestinalen Erkrankungen im Kindesalter und der pränatalen Tabakrauchexposition ist insgesamt spärlich.
- Psychische Erkrankungen, Verhaltensauffälligkeiten, neurologische Entwicklung: Zahlreiche Arbeiten belegen einen Zusammenhang zwischen Rauchen in der Schwangerschaft und psychiatrischen Erkrankungen, Attention Deficit Hyperactivity (ADHS), Störungen in der intellektuellen Entwicklung und z. T. auch Verhaltensauffälligkeiten.39–43
- Passivrauchexposition der Mutter in der Schwangerschaft: Nicht nur aktives Rauchen der Mutter in der Schwangerschaft kann den Fetus beeinträchtigen, sondern auch die Passivrauchexposition (Environmental Tobacco Smoke = ETS) durch Rauchen im Umfeld der Mutter kann sich negativ auf den Fetus auswirken.44
Pathophysiologische Hintergründe
Im Detail können die Auswirkungen des Rauchens in der Schwangerschaft auf den Fetus einerseits durch die direkte Wirkung der im Zigarettenrauch enthaltenen Toxine auf die fetalen Zellen erklärt werden. Andererseits werden indirekte Wirkungen der im Tabakrauch enthaltenen Stoffe auf die Plazenta vermutet. Nikotin wirkt im menschlichen Körper über Nikotin-Acetylcholinrezeptoren (nAChRs). Die höchste Affinität für Nikotin haben Leber, Niere, Milz, Lunge und Gehirn.45 Nikotin wird u. a. in der fetalen Lunge gespeichert, Spitzenkonzentrationen von Nikotin im Fetus entstehen 15–30 Minuten nach Zigarettenkonsum.46 Teilweise scheidet der Fetus das aufgenommene Nikotin in die Amnionflüssigkeit aus, wo es ebenfalls akkumuliert und höhere Konzentrationen als im maternalen Blut erreicht.47 Neben den schädigenden Effekten des Nikotins sind auch für andere Bestandteile des Tabakrauchs (Zyanide, Sulfide, Kadmium, CO, oxidative Produkte, Benzpyrene etc.) zytotoxische Effekte und direkte Wirkungen auf die feto-plazentare Einheit bekannt.48
Störung der Plazentafunktion: Tabakrauchexposition verursacht in der Plazenta bereits in der Frühschwangerschaft eine Verdickung der Basalmembran des Trophoblasten, eine Erhöhung des Kollagengehalts der mesenchymalen Zotten und eine Einschränkung der Vaskularisierung. Diese anatomischen Veränderungen wiederum verursachen enzymatische und synthetische Funktionsveränderungen. Dieser direkte Effekt auf die plazentare Funktion sowie auf die Proliferation und Differenzierung von Zellen erklärt die erhöhte Rate von Aborten, fetaler Wachstumsverzögerung, Totgeburt und Plazentalösungen bei Frauen, die während der Schwangerschaft rauchen.49
Möglichkeiten zur (medikamentösen) Intervention
Bei der aktuellen Datenlage können weder Bupropion noch Vareniclin
zur medikamentösen Rauchentwöhnungstherapie in der Schwangerschaft
empfohlen werden49–61, für die Nicotine Replacement Therapy (NRT) hingegen fehlt zurzeit der Nachweis einer ausreichenden Wirksamkeit62 und es bestehen deutliche toxikologische Bedenken wegen unerwünschter Nebenwirkungen21, 51, vor allem auf das fetale Gehirn62.
Medikamente einschließlich Nikotinersatz sollten daher vor Eintritt
einer Schwangerschaft die Entwöhnung erleichtern, während Schwangeren
psychotherapeutische Hilfen angeboten werden sollten. Die gleichzeitige
verhaltensmodifizierende Behandlung des Partners erhöhte in mehreren
Studien die Erfolgsrate der Raucherentwöhnung während der
Schwangerschaft.64–66
Derzeit bieten nur wenige Zentren in Österreich ein gezielt auf
Schwangere abgestimmtes Rauchentwöhnungs-Programm an, sodass hier noch
deutlicher Aufholbedarf besteht, um präpartale Tabakexposition zu
vermeiden. Des Weiteren ist eine umfassende Information der Schwangeren
(z. B. über den Mutter-Kind-Pass) nötig, in die nun auch die Hebammen
eingebunden werden. GynäkologInnen, die eine schwangere Frau im Rahmen
der Mutter-Kind-Pass-Untersuchungen betreuen, erfragen bei der Anamnese
Rauchgewohnheiten, dokumentieren dies auch auf der im Mutter-Kind-Pass
vorgesehenen Seite und sollen in dem Zusammenhang auch auf die
schädigende Wirkung des Rauchens hinweisen und diese Aufklärung auch
dokumentieren. Die Schwangerschaft stellt für viele Frauen eine sehr
große Motivation dar, mit dem Rauchen aufzuhören. GynäkologInnen,
KinderärztInnen, InternistInnen, LungenfachärztInnen und
AllgemeinmedizinerInnen sind gerade in dieser Zeit gefordert, Frauen auf
die schädigenden Effekte des Rauchens und die Möglichkeiten der
Rauchentwöhnung hinzuweisen und kompetent zu informieren. Gelegenheit
dazu bietet auch die im Mutter-Kind-Pass vorgesehene „Interne
Untersuchung“.